Para evitar automedicação, Anvisa quer mais rigor na compra de remédios:
Com objetivo de incentivar o uso racional dos medicamentos no Brasil, evitando que as pessoas tomem remédios por conta própria ao sinal de qualquer dor ou incômodo, a Agência Nacional de Vigilância Sanitária (Anvisa) publicou recentemente portaria criando um grupo de trabalho que vai definir medidas para evitar o problema.
O grupo será formado por 30 membros, entre representantes da indústria farmacêutica, do mercado varejista de medicamentos, dos conselhos profissionais, entre outros. A ideia é que esse grupo proponha medidas para exigência da receita médica na hora de comprar medicamentos.
O diretor-presidente da Anvisa, Dirceu Barbano, diz que o objetivo é evitar a automedicação no País: “O que se espera é que as pessoas sejam mais responsáveis tanto às farmácias, quanto os consumidores em relação ao consumo de medicamentos. Não está na pauta qualquer alteração em termos dos grupos que hoje são considerados de venda livre ou de tarja vermelha o grande problema é que a população sequer sabe disso direito porque é comum que as pessoas comprem qualquer medicamento sem receita.”
A primeira reunião da Força de Trabalho está prevista para o dia 2 de maio na sede da Anvisa, em Brasília.
Fonte: Hortência Guedes / Web Rádio Saúde
Bem Vindo ! Welcome!
Bem vindo ao nosso Blog, é um prazer ter sua visita registrada, esperamos que aprecie nosso conteúdo!T&B Pharma ConsultoriaWelcome to our Blog, it is a big pleasure to have your visit recorded; our expectation is that you enjoy our content!
T&B Pharma Consulting
segunda-feira, 22 de abril de 2013
quarta-feira, 17 de abril de 2013
Microbial Risk in Pharmaceutical Manufacturing and ICH Q9
Microbial Risk in Pharmaceutical Manufacturing and ICH Q9:
'via Blog this'
Microbial Risk in Pharmaceutical Manufacturing and ICH Q9
- Dennis E. Guilfoyle,
- Richard L. Friedman,
- Patricia F. Hughes,
- David Hussong,
- Amy S. Rosenberg and
- Kurt Brorson
+Author Affiliations
- Food and Drug Administration
Northeast Regional Laboratory - Food and Drug Administration
Center for Drug Evaluation and Research
- Correspondence author: Kurt Brorson, Food and Drug Administration: Center for Drug Evaluation and Research. journal@pda.org
Pharmaceutical manufacturing generally comprises a complex, multi-step processing system in which significant risks from microbial contamination are presented by diverse sources including raw materials, personnel, equipment, the facility, the environment, and container-closures. A comprehensive and rigorous approach to process design, operational control, and maintenance minimizes contamination risk to the product. A robust program should be in place to identify potential sources of microbiological contamination and to mitigate such risks. The risk management program should incorporate new information as knowledge and understanding regarding potential sources of risk expands. Indeed, as has often been found, subtle changes or anomalies that develop throughout the process lifecycle may introduce significant new microbial hazards that should be identified, evaluated, and appropriately addressed.
ICH Q9 describes important principles of sound quality risk management (QRM) that should be implemented by manufacturers to mitigate microbial hazards. The tools described in ICH Q9 can help manufacturers become aware of emerging microbial risks not only in emphasizing investigations into potential hazards, but in also stressing that risk management is not a “one time” exercise. Rather, “risk management should be an ongoing part of the quality management process” and “the output/results of the risk management process should be reviewed to take into account new knowledge and experience.” Thus, in regard to microbial contamination, manufacturers should monitor microbial profiles of natural raw material sources, and maintain current knowledge of contamination experiences reported by firms at technical conferences or in relevant literature (e.g., new veterinary findings of viral or bacterial risks from source animals). Appropriate measures should then be undertaken to mitigate risk based on such knowledge.
This awareness includes acquiring knowledge of the microorganisms that may enter or grow in the manufacturing process and cause upstream bioburden issues. Examples include viruses in raw materials that amplify in production cell culture, Gram-negative microorganisms that may proliferate at the pre-filtration stage, or downstream bioburden issues including finished product contamination. Recent examples of contamination problems have included bacteria that pass through sterilizing filters (e.g., Leptospira) and viruses present in raw materials (e.g., Vesivirus 2117) that are amplified during cell culture steps. We recommend that firms share these experiences in as open a manner as feasible, as these are public health risks that transcend competitive interests. As knowledge of emerging possible routes of contamination is made available, we also encourage manufacturers to share any appropriate risk mitigation measures that were adopted to better safeguard the product.
With this background, we would like to share the following recommendations regarding microbial risk management:
- Review available external information from scientific literature, conference presentations, and technical reports from industry organizations that may provide vital information on microbial risks to the process. Where appropriate, mitigation strategies can then be proactively enacted to counter such risks.
- Use Quality Risk Management (QRM, see ICH Q9) as a key element of your quality system (ICH Q10) to enable sound initial decisions, followed by subsequent continual improvements to design, control, and maintenance to vigilantly prevent microbial risks. Knowledge management is another important element of an effective quality system. Maintaining consistent manufacturing control to prevent contamination requires effective communication between departments, along with effective management of, and learning from, large information streams.
- Use QRM to define corrective and preventive action (CAPA) plans in response to newly identified sources of contamination risk throughout the lifecycle of the product. ICH Q9 and ICH Q10 are again good references, as they include guidance on performing effective and risk-based investigations and CAPA). A more global response plan may be warranted in some cases to prevent risks to other products and processes.
- Use appropriate laboratory tests for bacteria, fungi, and viruses. Particularly for viruses, implementation of orthogonal test methods may mitigate detection gaps. Moreover, highly sensitive high-throughput screening methods may be used on a periodic basis to help update the range of routine tests needed as new adventitious agents posing risk are identified.
- Incorporate an understanding of nonsterile and sterile drug risk assessment. For a sterile drug, contamination with a microorganism is an intolerable risk to the patient. For nonsterile dosage forms, assessing microbial risk is more nuanced, and consideration should be given to the following four elements:
- Intended use of drug, including understanding of the dosage form and how administered. The route of administration (e.g., oral, topical, nasal, inhaler, injectable.) is an important aspect of microbial risk. For example, for nonsterile topical drugs, this includes understanding the site of application as part of assessing vulnerability to potential for infection. While a nonsterile topical drug should not be applied to a burn or wound, it would be unlikely to pose a hazard to healthy, intact skin.
- Identity of microorganisms in the product, and “infective dose” (i.e., quantity of a microbe that would lead to pathogenicity). This factor includes understanding of the total microbial count and identity of microbes in the product, as well as whether the latter may be objectionable in view of the product's intended use. Note that the infective dose can vary substantially based on the next factor.
- Susceptibility of the patient. Knowledge of the nature of the population taking the drug, including whether some patients may be at increased risk, is also significant consideration. Examples of higher risk hosts are those with risk factors such as: chronic disease, shock or trauma, pregnant, immunocompromised, elderly, or very young.
- Composition of the product. Preservatives are not a substitute for good manufacturing practices and is only intended to mitigate risk from possible incidental contamination during multiple uses. When evaluating this factor, consider whether the product has effective antimicrobial/preservative properties, the product can still support growth of certain organisms, or if it permits stasis of any microbial contamination.
A risk-based assessment incorporating the five recommendations above should be conducted by appropriate technical staff, including microbiology personnel with specialized training in the interpretation of microbiological data. Medical expertise may also be necessary to assess potential patient hazard. A final determination of process consistency and product safety that is both objective and collaborative should be supported by management. Ultimately, by incorporating a lifecycle approach to QRM, the quality system will help prevent surprises and assure the consistent supply of safe and effective medicines.
- © PDA, Inc. 2013
'via Blog this'
Anvisa fixa regras para solicitar registro de medicamentos por processo eletrônico
Anvisa fixa regras para solicitar registro de medicamentos por processo eletrônico:
Paula Laboissière
Repórter da Agência Brasil
Brasília – Uma resolução da Agência Nacional de Vigilância Sanitária (Anvisa) publicada hoje (15) no Diário Oficial da União fixa regras para o processo eletrônico de solicitação de registro de novos medicamentos.
Na semana passada, o ministro da Saúde, Alexandre Padilha, anunciou um pacote de medidas para acelerar o registro de remédios no país. Entre as mudanças está a criação do sistema eletrônico, que vai eliminar o uso de papel durante o procedimento.
De acordo com a resolução, o protocolo eletrônico da solicitação de registro está sujeito ao pagamento de uma taxa de fiscalização de vigilância sanitária, em até 30 dias. Já a efetivação do protocolo deve ocorrer em até dois dias úteis, a contar da data do pagamento.
“O não pagamento da taxa no prazo estipulado resultará no cancelamento automático do peticionamento no sistema de informações da Anvisa e na não protocolização do pedido”, ressaltou a publicação.
A resolução entra em vigor hoje. A meta do governo é, até dezembro, zerar a fila de produtos que aguardam há pelo menos seis meses por registro no Brasil.
Edição: Denise Griesinger
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias é necessário apenas dar crédito à Agência Brasil
Paula Laboissière
Repórter da Agência Brasil
Brasília – Uma resolução da Agência Nacional de Vigilância Sanitária (Anvisa) publicada hoje (15) no Diário Oficial da União fixa regras para o processo eletrônico de solicitação de registro de novos medicamentos.
Na semana passada, o ministro da Saúde, Alexandre Padilha, anunciou um pacote de medidas para acelerar o registro de remédios no país. Entre as mudanças está a criação do sistema eletrônico, que vai eliminar o uso de papel durante o procedimento.
De acordo com a resolução, o protocolo eletrônico da solicitação de registro está sujeito ao pagamento de uma taxa de fiscalização de vigilância sanitária, em até 30 dias. Já a efetivação do protocolo deve ocorrer em até dois dias úteis, a contar da data do pagamento.
“O não pagamento da taxa no prazo estipulado resultará no cancelamento automático do peticionamento no sistema de informações da Anvisa e na não protocolização do pedido”, ressaltou a publicação.
A resolução entra em vigor hoje. A meta do governo é, até dezembro, zerar a fila de produtos que aguardam há pelo menos seis meses por registro no Brasil.
Edição: Denise Griesinger
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias é necessário apenas dar crédito à Agência Brasil
Retomada da produção da insulina marca história da saúde pública no Brasil, diz Padilha
Retomada da produção da insulina marca história da saúde pública no Brasil, diz Padilha:
Paula Laboissière
Repórter da Agência Brasil
Brasília – O ministro da Saúde, Alexandre Padilha, anunciou hoje (16) a retomada da produção de insulina humana, destacando que a medida marca a história da saúde pública no país. Segundo ele, o Brasil será a quarta nação no mundo a produzir o medicamento, indicado para o tratamento do diabetes. A expectativa é que o produto chegue às farmácias em 2014.
Durante cerimônia oficial em Belo Horizonte, ele avaliou que é preciso aproveitar o potencial da saúde para estimular a economia brasileira. Segundo Padilha, o setor demanda 9% do Produto Interno Bruto (PIB) brasileiro, conta com 16 milhões de trabalhadores na produção de medicamentos e equipamentos e representa 30% do esforço nacional de inovação.
A produção de insulina humana no Brasil foi interrompida em 2001. Desde então, o país depende de importações. De acordo com o ministro, a compra de produtos biológicos, como a insulina, representa um impacto de 34% no orçamento da pasta.
A estimativa do ministério é que 7,6 milhões de brasileiros tenham diabetes, mas o número pode chegar a 10 milhões se considerados os casos ainda não diagnosticados. Atualmente, 1 milhão de pessoas utilizam insulina pelo Sistema Único de Saúde (SUS).
“Além de incentivar a inovação, estamos construindo segurança para os milhões de diabéticos do nosso país, entregando insulina de qualidade”, disse Padilha. “Em 2014, vamos ter nas farmácias populares insulina made in Brasil”, completou. A insulina brasileira será produzida em uma parceria entre a Fundação Oswaldo Cruz (Fiocruz) e o laboratório Biomm, na cidade de Nova Lima, na região metropolitana de Belo Horizonte.
A previsão, segundo o governo, é de investimento de R$ 430 milhões nos próximos cinco anos - R$ 80 milhões do Ministério da Saúde e Fiocruz e o restante por meio de financiamento do Banco Nacional do Desenvolvimento Econômico e Social (BNDES).
A presidenta Dilma Rousseff destacou que o país pretende competir no mercado internacional de insulina preservando preço, prazo e qualidade. “Não temos hoje a insulina pronta. Temos a certeza de que, em 2014, colocaremos essa insulina em todas as farmácias populares e conseguiremos, com isso, mudar a história do Brasil no que se refere a uma linha tecnológica.”
Para o ministro do Desenvolvimento, Indústria e Comércio Exterior, Fernando Pimentel, a retomada da produção representa o sucesso da política industrial brasileira. Ele lembrou que o Brasil ocupa posições de destaque no consumo de diversos produtos e que, “quem tem mercado, tem obrigação de ter produção”.
Ainda durante a cerimônia, o governador de Minas Gerais, Antônio Anastasia, avaliou que o anúncio representa um investimento altamente estratégico não só para o estado, mas para o Brasil e para o mundo, já que o número de diabéticos é cada vez maior.
Edição: Lílian Beraldo//Matéria alterada às 15h36. A assessoria do Ministério da Saúde corrigiu informação, prestada por meio de nota, de que o medicamento deve chegar às farmácias em 2017. O produto estará disponível à população a partir de 2014, segundo a assessoria. A informação anterior da assessoria foi retirada do texto
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias é necessário apenas dar crédito à Agência Brasil
Paula Laboissière
Repórter da Agência Brasil
Brasília – O ministro da Saúde, Alexandre Padilha, anunciou hoje (16) a retomada da produção de insulina humana, destacando que a medida marca a história da saúde pública no país. Segundo ele, o Brasil será a quarta nação no mundo a produzir o medicamento, indicado para o tratamento do diabetes. A expectativa é que o produto chegue às farmácias em 2014.
Durante cerimônia oficial em Belo Horizonte, ele avaliou que é preciso aproveitar o potencial da saúde para estimular a economia brasileira. Segundo Padilha, o setor demanda 9% do Produto Interno Bruto (PIB) brasileiro, conta com 16 milhões de trabalhadores na produção de medicamentos e equipamentos e representa 30% do esforço nacional de inovação.
A produção de insulina humana no Brasil foi interrompida em 2001. Desde então, o país depende de importações. De acordo com o ministro, a compra de produtos biológicos, como a insulina, representa um impacto de 34% no orçamento da pasta.
A estimativa do ministério é que 7,6 milhões de brasileiros tenham diabetes, mas o número pode chegar a 10 milhões se considerados os casos ainda não diagnosticados. Atualmente, 1 milhão de pessoas utilizam insulina pelo Sistema Único de Saúde (SUS).
“Além de incentivar a inovação, estamos construindo segurança para os milhões de diabéticos do nosso país, entregando insulina de qualidade”, disse Padilha. “Em 2014, vamos ter nas farmácias populares insulina made in Brasil”, completou. A insulina brasileira será produzida em uma parceria entre a Fundação Oswaldo Cruz (Fiocruz) e o laboratório Biomm, na cidade de Nova Lima, na região metropolitana de Belo Horizonte.
A previsão, segundo o governo, é de investimento de R$ 430 milhões nos próximos cinco anos - R$ 80 milhões do Ministério da Saúde e Fiocruz e o restante por meio de financiamento do Banco Nacional do Desenvolvimento Econômico e Social (BNDES).
A presidenta Dilma Rousseff destacou que o país pretende competir no mercado internacional de insulina preservando preço, prazo e qualidade. “Não temos hoje a insulina pronta. Temos a certeza de que, em 2014, colocaremos essa insulina em todas as farmácias populares e conseguiremos, com isso, mudar a história do Brasil no que se refere a uma linha tecnológica.”
Para o ministro do Desenvolvimento, Indústria e Comércio Exterior, Fernando Pimentel, a retomada da produção representa o sucesso da política industrial brasileira. Ele lembrou que o Brasil ocupa posições de destaque no consumo de diversos produtos e que, “quem tem mercado, tem obrigação de ter produção”.
Ainda durante a cerimônia, o governador de Minas Gerais, Antônio Anastasia, avaliou que o anúncio representa um investimento altamente estratégico não só para o estado, mas para o Brasil e para o mundo, já que o número de diabéticos é cada vez maior.
Edição: Lílian Beraldo//Matéria alterada às 15h36. A assessoria do Ministério da Saúde corrigiu informação, prestada por meio de nota, de que o medicamento deve chegar às farmácias em 2017. O produto estará disponível à população a partir de 2014, segundo a assessoria. A informação anterior da assessoria foi retirada do texto
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias é necessário apenas dar crédito à Agência Brasil
Anvisa vai colocar em consulta pública normas para recall de alimentos
Anvisa vai colocar em consulta pública normas para recall de alimentos:
Aline Leal
Repórter da Agência Brasil
Brasília - A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu hoje (16) colocar em consulta pública normas sobre recolhimento de alimentos. A proposta da agência é que os fabricantes sejam obrigados a comunicar no prazo de 24 horas a Anvisa sobre problemas na fabricação de alimentos que podem causar danos à saúde. A proposta prevê como deverá ser feita divulgação de um comunicado à população.
De acordo com o relator da proposta, diretor José Agenor Álvares da Silva, casos como o da bebida da marca Ades chegaram ao conhecimento da Anvisa pela imprensa. Na reunião da diretoria, ele explicou que não existe regra que obrigue as empresas a comunicar às autoridades de Vigilância Sanitária esse tipo de ocorrência.
“A regulamentação traz a responsabilização do setor produtivo. Traz pra ele a responsabilização e desonera o sistema nacional, que ao invés de ir atrás da informação traz para o produtor a obrigação de informar”, disse Denise Rezende, gerente-geral de alimentos da Anvisa, durante reunião da diretoria. Segundo a gerente, com a medida, o mercado vai ter que adotar um sistema de rastreamento dos produtos. Denise lembrou que, no caso Ades, a empresa não sabia onde estavam as unidades contaminadas.
Agenor Álvares negou que a decisão de abrir a consulta pública foi tomada agora por causa do caso Ades, e informou que o tema vinha sendo tratado pela Anvisa desde 2007.
No mês passado, a Unilever anunciou o recall de 96 unidades da bebida Ades de 1,5 litro, sabor maçã, por falhas no processo de envasamento da bebida. O produto foi contaminado com soda caústica. A Anvisa suspendeu a fabricação, a distribuição, a venda e o consumo, em todo o território nacional, de lotes de todos os sabores da bebida fabricadas em Pouso Alegre (MG), onde ocorreu o problema.
Em 2011, caso semelhante ocorreu com o achocolatado Toddynho. A Secretaria de Saúde do Rio Grande do Sul registrou pelo menos 39 casos de intoxicação por causa da bebida, como irritação e queimaduras na boca de crianças. Na época, a Anvisa pediu a inspeção da fábrica do produto e a empresa fabricante fez o recall de 80 unidades do produto.
Edição: Carolina Pimentel
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias é necessário apenas dar crédito à Agência Brasil
Aline Leal
Repórter da Agência Brasil
Brasília - A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu hoje (16) colocar em consulta pública normas sobre recolhimento de alimentos. A proposta da agência é que os fabricantes sejam obrigados a comunicar no prazo de 24 horas a Anvisa sobre problemas na fabricação de alimentos que podem causar danos à saúde. A proposta prevê como deverá ser feita divulgação de um comunicado à população.
De acordo com o relator da proposta, diretor José Agenor Álvares da Silva, casos como o da bebida da marca Ades chegaram ao conhecimento da Anvisa pela imprensa. Na reunião da diretoria, ele explicou que não existe regra que obrigue as empresas a comunicar às autoridades de Vigilância Sanitária esse tipo de ocorrência.
“A regulamentação traz a responsabilização do setor produtivo. Traz pra ele a responsabilização e desonera o sistema nacional, que ao invés de ir atrás da informação traz para o produtor a obrigação de informar”, disse Denise Rezende, gerente-geral de alimentos da Anvisa, durante reunião da diretoria. Segundo a gerente, com a medida, o mercado vai ter que adotar um sistema de rastreamento dos produtos. Denise lembrou que, no caso Ades, a empresa não sabia onde estavam as unidades contaminadas.
Agenor Álvares negou que a decisão de abrir a consulta pública foi tomada agora por causa do caso Ades, e informou que o tema vinha sendo tratado pela Anvisa desde 2007.
No mês passado, a Unilever anunciou o recall de 96 unidades da bebida Ades de 1,5 litro, sabor maçã, por falhas no processo de envasamento da bebida. O produto foi contaminado com soda caústica. A Anvisa suspendeu a fabricação, a distribuição, a venda e o consumo, em todo o território nacional, de lotes de todos os sabores da bebida fabricadas em Pouso Alegre (MG), onde ocorreu o problema.
Em 2011, caso semelhante ocorreu com o achocolatado Toddynho. A Secretaria de Saúde do Rio Grande do Sul registrou pelo menos 39 casos de intoxicação por causa da bebida, como irritação e queimaduras na boca de crianças. Na época, a Anvisa pediu a inspeção da fábrica do produto e a empresa fabricante fez o recall de 80 unidades do produto.
Edição: Carolina Pimentel
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias é necessário apenas dar crédito à Agência Brasil
BRASIL RETOMA PRODUÇÃO NACIONAL DE INSULINA
Notícia SnifDoctor:
O Ministério da Saúde, por meio de parceria do laboratório público Fundação Oswaldo Cruz (Fiocruz), com a empresa brasileira Biom, promoverá a retomada da produção nacional de insulina, medicamento vital para o controle de diabetes. A previsão de investimento é de R$ 430 milhões nos próximos cinco anos – R$ 80 milhões do Ministério da Saúde e Fiocruz, e o restante via financiamento do Banco Nacional de Desenvolvimento Econômico e Social (BNDES).
O anúncio ocorreu em 16 de abril, em Belo Horizonte, em cerimônia com a presidenta da República, Dilma Rousseff, e os ministros da Saúde, Alexandre Padilha, e do Desenvolvimento, Indústria e Comércio Exterior (MDIC), Fernando Pimentel.
A fábrica da Biomm deve começar a produzir a partir de 2015 e a população terá acesso ao medicamento nacional em 2017. A produção nacional de insulina – interrompida em 2001 – representa avanço não apenas na assistência, mas também confere ao Brasil autonomia e reduz a vulnerabilidade do país frente a potenciais crises internacionais de produção. “Hoje, política industrial tem de competir no mercado global com preço, prazo e qualidade. Não é admissível que o Brasil faça substituição de importação. Este é um passo importante: unir área industrial, ciência e tecnologia, e educação para aumentar a produtividade”, acrescentou a presidenta.
Com a retomada da produção da insulina, o Brasil volta a fazer parte do seleto grupo de quatro países que produzem insulina, ao lado de Ucrânia, Dinamarca e Estados Unidos, lembrou o ministro da Saúde. “A retomada só se tornou viável porque o programa Farmácia Popular, do Ministério da Saúde, criou um mercado que sustenta a produção. Aumentou cinco vezes o número de pessoas com acesso a medicamentos de graça. Subiu de 15 mil para 25 mil o número de farmácias que ofertam esses medicamentos”, afirmou Padilha. “Mercado garantido no Brasil, podendo ousar no mercado global”.
ASSISTÊNCIA – Atualmente, há cerca de 10 milhões de diabéticos no país. Desses, 1,1 milhão utilizam a insulina disponibilizada pelo Sistema Único de Saúde (SUS). Em 2012, o consumo médio de medicamentos antidiabéticos pela rede pública de saúde foi de cerca de 15 milhões de frascos NPH e cerca de 1,7 milhões de frascos de insulina – 1,2 milhões de frascos do tipo NPH e 145 mil frascos da regular. A Biomm produzirá 50% da insulina distribuída no SUS.
“O Brasil está entre o segundo e o quarto mercado do mundo para todo e qualquer produto que se consuma: de grampo de cabelo a avião a jato. Quem tem mercado desses tem obrigação de deter produção de qualidade, com domínio tecnológico. Aqui estamos diante de um exemplo vitorioso”, acrescentou o ministro Fernando Pimentel.
COMPLEXO DA SAÚDE – A construção de uma fábrica nacional de insulina está inserida na estratégia do governo federal de aumentar a autonomia do país em relação ao mercado externo de medicamentos e equipamentos de Saúde. Na semana passada, o ministro Alexandre Padilha anunciou uma série de medidas para impulsionar a indústria brasileira no setor Saúde. Foram firmadas oito parcerias entre laboratórios públicos e privados para a produção nacional de medicamentos e equipamentos, que vão gerar economia de R$ 354 milhões em cinco anos.
Com os novos acordos, estão em vigor um total de 63 parcerias entre 15 laboratórios públicos e 35 privados para a produção nacional de 61 medicamentos e seis equipamentos. Estima-se que essas parcerias resultem em uma economia anual aproximada de R$ 2,8 bilhões para o Ministério da Saúde. O governo federal também vai disponibilizar R$ 7 bilhões para a concessão de crédito a empresas brasileiras com projetos inovadores no campo da saúde, além da injeção de R$ 1,3 bilhão na infraestrutura de laboratórios públicos.
'via Blog this'
O Ministério da Saúde, por meio de parceria do laboratório público Fundação Oswaldo Cruz (Fiocruz), com a empresa brasileira Biom, promoverá a retomada da produção nacional de insulina, medicamento vital para o controle de diabetes. A previsão de investimento é de R$ 430 milhões nos próximos cinco anos – R$ 80 milhões do Ministério da Saúde e Fiocruz, e o restante via financiamento do Banco Nacional de Desenvolvimento Econômico e Social (BNDES).
O anúncio ocorreu em 16 de abril, em Belo Horizonte, em cerimônia com a presidenta da República, Dilma Rousseff, e os ministros da Saúde, Alexandre Padilha, e do Desenvolvimento, Indústria e Comércio Exterior (MDIC), Fernando Pimentel.
A fábrica da Biomm deve começar a produzir a partir de 2015 e a população terá acesso ao medicamento nacional em 2017. A produção nacional de insulina – interrompida em 2001 – representa avanço não apenas na assistência, mas também confere ao Brasil autonomia e reduz a vulnerabilidade do país frente a potenciais crises internacionais de produção. “Hoje, política industrial tem de competir no mercado global com preço, prazo e qualidade. Não é admissível que o Brasil faça substituição de importação. Este é um passo importante: unir área industrial, ciência e tecnologia, e educação para aumentar a produtividade”, acrescentou a presidenta.
Com a retomada da produção da insulina, o Brasil volta a fazer parte do seleto grupo de quatro países que produzem insulina, ao lado de Ucrânia, Dinamarca e Estados Unidos, lembrou o ministro da Saúde. “A retomada só se tornou viável porque o programa Farmácia Popular, do Ministério da Saúde, criou um mercado que sustenta a produção. Aumentou cinco vezes o número de pessoas com acesso a medicamentos de graça. Subiu de 15 mil para 25 mil o número de farmácias que ofertam esses medicamentos”, afirmou Padilha. “Mercado garantido no Brasil, podendo ousar no mercado global”.
ASSISTÊNCIA – Atualmente, há cerca de 10 milhões de diabéticos no país. Desses, 1,1 milhão utilizam a insulina disponibilizada pelo Sistema Único de Saúde (SUS). Em 2012, o consumo médio de medicamentos antidiabéticos pela rede pública de saúde foi de cerca de 15 milhões de frascos NPH e cerca de 1,7 milhões de frascos de insulina – 1,2 milhões de frascos do tipo NPH e 145 mil frascos da regular. A Biomm produzirá 50% da insulina distribuída no SUS.
“O Brasil está entre o segundo e o quarto mercado do mundo para todo e qualquer produto que se consuma: de grampo de cabelo a avião a jato. Quem tem mercado desses tem obrigação de deter produção de qualidade, com domínio tecnológico. Aqui estamos diante de um exemplo vitorioso”, acrescentou o ministro Fernando Pimentel.
COMPLEXO DA SAÚDE – A construção de uma fábrica nacional de insulina está inserida na estratégia do governo federal de aumentar a autonomia do país em relação ao mercado externo de medicamentos e equipamentos de Saúde. Na semana passada, o ministro Alexandre Padilha anunciou uma série de medidas para impulsionar a indústria brasileira no setor Saúde. Foram firmadas oito parcerias entre laboratórios públicos e privados para a produção nacional de medicamentos e equipamentos, que vão gerar economia de R$ 354 milhões em cinco anos.
Com os novos acordos, estão em vigor um total de 63 parcerias entre 15 laboratórios públicos e 35 privados para a produção nacional de 61 medicamentos e seis equipamentos. Estima-se que essas parcerias resultem em uma economia anual aproximada de R$ 2,8 bilhões para o Ministério da Saúde. O governo federal também vai disponibilizar R$ 7 bilhões para a concessão de crédito a empresas brasileiras com projetos inovadores no campo da saúde, além da injeção de R$ 1,3 bilhão na infraestrutura de laboratórios públicos.
'via Blog this'
terça-feira, 16 de abril de 2013
Bactérias resistentes abrem a possibilidade de uma era pós-antibióticos - DIKAJOB
Bactérias resistentes abrem a possibilidade de uma era pós-antibióticos - DIKAJOB:
'via Blog this'
FOLHA DE SAO PAULO
MARIANA VERSOLATO
ENVIADA ESPECIAL A UPPSALA (SUÉCIA)
ENVIADA ESPECIAL A UPPSALA (SUÉCIA)
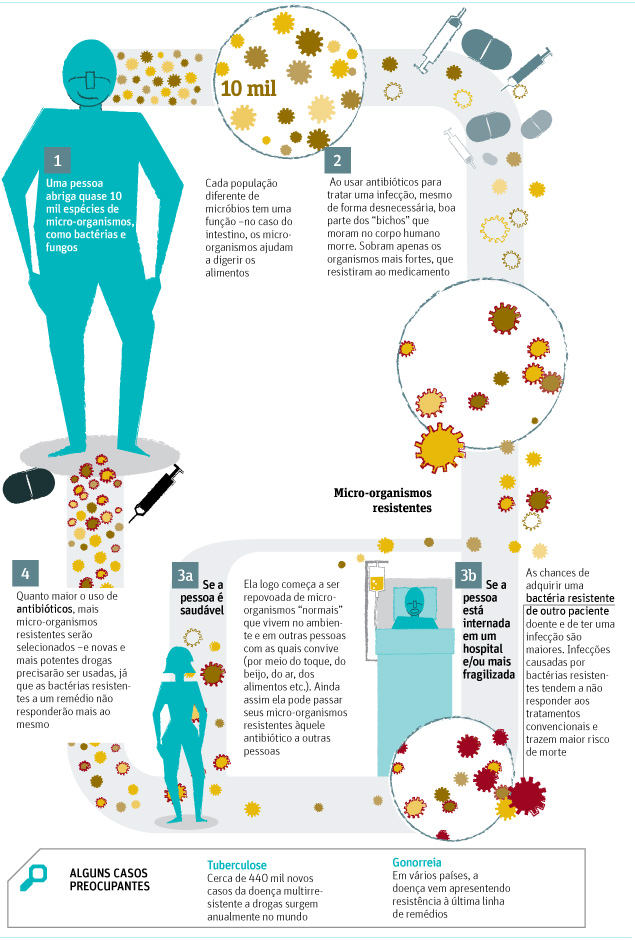
"O mundo está prestes a perder essas curas milagrosas", já disse a diretora da OMS (Organização Mundial da Saúde), Margaret Chan, sobre os antibióticos.
Chan se referiu a um futuro tenebroso --e possível-- no qual infecções comuns não terão cura. É o que especialistas chamam de era pós-antibióticos.
Esses remédios têm como alvo as bactérias, mas esses micro-organismos sempre acham uma forma de sobreviver e se tornarem resistentes, o que pede o uso de novos medicamentos. Por isso, antibióticos têm um tempo determinado de validade.
O problema é que o arsenal terapêutico e o desenvolvimento de novas drogas só diminuiu nas últimas décadas. A última classe de antibióticos foi descoberta em 1987.
O mal uso dos antibióticos (seja sem necessidade ou por tempo e dose incorretos) e o maior tráfego global de bactérias resistentes pioram o cenário.
Neste ano, um relatório dos Centros de Controle de Doenças dos EUA chamou a atenção para o problema da gonorreia resistente às cefalosporinas, classe de antibióticos usados no tratamento dessa doença sexualmente transmissível.
Para retardar o surgimento de uma superbactéria resistente, os CDCs mudaram as diretrizes do tratamento, que agora deve combinar um remédio oral e outro injetável.
As bactérias causadoras da tuberculose também geram preocupação, assim como a KPC, resistente à maioria dos medicamentos e que normalmente atinge pessoas hospitalizadas.
Na semana passada, o Hospital de Clínicas da Unicamp anunciou que teve 11 casos de infecções pela KPC entre dezembro e março.
Na semana passada, o Hospital de Clínicas da Unicamp anunciou que teve 11 casos de infecções pela KPC entre dezembro e março.
FALTA DE INVESTIMENTO
O corte em investimentos em pesquisa e desenvolvimento de antibióticos pelos laboratórios multinacionais se deve, em parte, a fusões recentes entre as grandes empresas do setor.
Segundo a OMS, 8 das 15 maiores farmacêuticas que tinham programas de descoberta de antibióticos abandonaram essa área --outras duas reduziram seus esforços.
Anna Sara Levin, coordenadora do grupo de controle de infecção hospitalar do Hospital das Clínicas da USP, lembra que drogas antigas para hipertensão e diabetes, desenvolvidas nos anos 1950, ainda funcionam, ainda que existam opções mais modernas.
"Já com os antibióticos, a resistência vai aparecer de qualquer maneira. Como as pesquisas são caras e levam tempo, a indústria vê isso como um mau negócio."
É nesse "vácuo" que médicos, pesquisadores e autoridades de saúde da Suécia veem "uma oportunidade e a responsabilidade" de oferecer soluções, segundo Linus Sandegren, pesquisador do departamento de bioquímica médica e microbiologia da Universidade de Uppsala, no norte da Suécia.
O país tem uma taxa baixa de resistência a antibióticos, mas cinco universidades na região de Estocolmo e Uppsala desenvolvem mais de 30 projetos de estudo nessa área.
"O país percebe que a resistência é um problema enorme e que é preciso investir dinheiro agora para evitar uma catástrofe depois", afirma Anna Zorzet, diretora-executiva-assistente do ReAct, uma rede global independente contra a resistência a antibióticos, sediada na Universidade de Uppsala.
"O país percebe que a resistência é um problema enorme e que é preciso investir dinheiro agora para evitar uma catástrofe depois", afirma Anna Zorzet, diretora-executiva-assistente do ReAct, uma rede global independente contra a resistência a antibióticos, sediada na Universidade de Uppsala.
Em 2012, o primeiro-ministro sueco anunciou um investimento de US$ 220 milhões para os quatro anos seguintes em pesquisas nessa área.
As investigações incluem o desenvolvimento de novas drogas e a revisão de medicamentos antigos ou que foram descartados anteriormente.
Um dos estudos clínicos, no Hospital Universitário de Uppsala, pretende determinar regimes de dosagem ideais de antibióticos e testar combinações de drogas existentes contra bactérias multirresistentes.
NOVA GERAÇÃO
Mas só o lançamento de novos antibióticos no mercado não vai resolver o problema da resistência a antibióticos, segundo Diarmaid Hughes, professor de bacteriologia molecular médica da Universidade de Uppsala.
"É necessário antes aprender sobre o uso e o abuso de antibióticos das últimas décadas que fizeram o problema da resistência chegar nesse estado atual; chegar à raiz do problema antes do possível mau uso de uma nova geração de antibióticos."
Anna Sara Levin, do HC, toca no mesmo ponto. "Para não vivermos uma situação catastrófica no futuro, a solução é a prevenção. Isso inclui o uso racional dos antibióticos e o controle das infecções hospitalares."
Segundo ela, a maior parte do problema no Brasil não está na geração desses micro-organismos resistentes mas sim na sua transmissão.
"Cada 'monstro' gerado é disseminado para outros pacientes e outros hospitais. Por isso, é primordial melhorar a qualidade dos serviços de saúde."
| Editoria de arte/Folhapress | ||
 |
'via Blog this'
sábado, 13 de abril de 2013
Report from Brazil - Pharmaceutical Technology
Report from Brazil - Pharmaceutical Technology:
Brazil's major vaccine producer innovates with stem-cell research.
The institute started gaining global recognition as it ventured into research on animal venom, which consequently led to the production of anti-venom. In 1915, the institute was renamed Butantan Institute. Known as Butantan, the institute currently conducts technical and scientific activities in two major areas—the production of serum and biomedical research.
'via Blog this'
In 1898, an outbreak of Bubonic plague struck the port of Santos in São Paulo, Brazil. A year later, a local bacteriological institute set up a unit to produce anti-plague serum in a government-owned farm known as Butantan, which was renamed the Butantan Serumtherapy Institute in 1901.
 NASH PHOTOS/GETTY IMAGES |
The institute claims to be Latin America's biggest vaccine producer, with an output of more than 300 million doses every year. Today, Butantan is considered a major contributor to Brazil's public health, having approximately 1700 staff members, including 180 scientific researchers specializing in innovation.
Innovation using Brazilian technology
"I believe Butantan Institute is an important partner to [Brazil's pharma] companies as 80% of all vaccines used in Brazil are produced by this institute," says Irina Kerkis, director of the genetics laboratory at Butantan Institute. Despite its struggles in a globally competitive market, the institute reaches for innovation while balancing research and production according to its researchers.
In its search for local and global recognition, Butantan has developed major research capabilities at its genetics laboratory, including the expertise to retrieve stem cells from milk teeth. Nelson Foresto Lizier, a scientific researcher working at Butantan's genetics laboratory, says that this project is vital given that stem cells have the ability to generate almost any human cell. The study, which is considered the first of its kind in Brazil, is being developed with "100% Brazilian technology" according to Lizier.
The development of the technology started in 2004. It was initially privately funded; however, six years later, investment from major public agencies began pouring in according to Kerkis.
Implications for the pharmaceutical sector
Private pharmaceutical companies in Brazil acknowledge the importance of stem-cell research. "Butantan and the national pharmaceutical industry are major partners and the institute is willing to develop research studies together with the private sector," says Henrique Uchió Tada, executive technical director for the National Pharmaceutical Laboratories Association (Alanac).
According to Tada, the various potential benefits and applications of the stem-cell project include, among others, treatments for diabetes, heart illnesses, liver problems, multiple sclerosis, brain lesions, Parkinson disease, inflammatory diseases, and the recovery of human skin and organs. "However, the development of related pharma products is still a little far away for the national pharmaceutical industry," he adds. Tada explains that stem-cell studies conducted by national pharmaceutical laboratories focus on a type of treatment that is not considered traditional. He says that treatment is obtained through the retrieval of stem cells from the individual's body and not through a synthetic drug applied for treating an entire population with the exact same illness or disease.
Several bioethics experts in Brazil believe that there may be a gap between the pharmaceutical industry and stem-cell treatments. The future might not require the use of drugs as we know them, they say. For example, patients would be able to use their own cells to cure diseases, and as a result, the pharmaceutical industry would be affected because of profit loss from the steep drop in sales. Tada, however, believes that pharmaceutical firms could benefit from stem-cell advances if they develop a method that makes use of stem cells in treatment procedures.
According to both Kerkis and Lizier, the pharmaceutical industry has shown great interest in stem-cell research because of its potential as "biotools" for developing and testing new products. "The development of new drugs through the study of stem cells could become a reality by conjoining findings from pharmacology and cellular biology studies as the variety of substances produced by cultured stem cells could open new doors for pharmacology in general," says Kerkis, whose statement was supported by Lizier.
Butantan's stem-cell research
Embryonic stem cells, obtained by a special technique developed by Butantan researchers, are already being tested in humans. According to the institute, results from these clinical studies, which involve reconstruction of the tissue that covers the human eye cornea for example, are expected to be reported during the second half of 2013.
Butantan's biggest finding is that, through the method developed, it is possible to obtain sufficient quantities of cells to be applied in humans. According to Lizier, one of the advantages of working with stem cells from milk teeth is that these teeth are biological materials that are generally discarded and children have an average of 20 milk teeth that are changed during their lifetime. Moreover, the extraction of the internal material from the teeth is simple and not as painful when compared with other techniques.
With the method developed at Butantan, it is possible to obtain cells that are considered immature compared with other populations of adult stem cells found in other tissues. According to Lizier, the technique uses cells that are similar to embryonic cells, but without the bioethics issues involved or the possibilities of inducing tumor growth during treatments. Using Butantan's technology, researchers can retrieve approximately 100 billion cells from a small fragment of dental pulp. "The figure is big enough for treating up to 100 patients," says Lizier.
Butantan has scientific proof that stem cells from milk teeth could play an important and safe role in treatments involving bone, cartilage, muscle, and neural tissue regeneration as well as in therapies for immune and metabolic disorders and dentistry. As the research develops, other applications of the institute's technology could prove useful in the near future.
—Hellen Berger is a business writer based in São Paulo, Brazil.
'via Blog this'
terça-feira, 9 de abril de 2013
sexta-feira, 5 de abril de 2013
Anvisa abre consulta pública sobre rastreabilidade de medicamentos
Anvisa abre consulta pública sobre rastreabilidade de medicamentos:
3 de abril de 2013
'via Blog this'
Anvisa abre consulta pública sobre rastreabilidade de medicamentos
3 de abril de 2013

A diretoria da Anvisa encaminhou para consulta pública proposta que cria o Sistema Nacional de Controle de Medicamentos. A proposta de resolução está publicada na edição desta quarta-feira (3/4) do Diário Oficial da União.
O Sistema Nacional de Controle de Medicamentos (SNCM) institui os mecanismos e procedimentos que vão garantir o rastreamento dos medicamentos. O sistema propõe que o controle comece na produção e acompanhe o medicamento até a prescrição destes produtos.
A Diretoria Colegiada da Anvisa definiu que a tecnologia a ser adotada para o SNCM é o código de barras bidimensional, a Datamatrix. Trata-se do mecanismo de captura, armazenamento e transmissão eletrônica de dados necessários ao rastreamento de medicamentos no Brasil.
A proposta encaminhada para consulta pública por 30 dias determina que a responsabilidade de zelar pela qualidade, pela segurança e pela eficácia dos medicamentos deve ser compartilhada entre todos os agentes que atuam na cadeia de produção, distribuição e consumo desses produtos.
O diretor-presidente da Anvisa, Dirceu Barbano, explica que “as empresas detentoras de registro junto à Anvisa serão responsáveis por gerar e dispor em cada embalagem de medicamento um número chamado de Identificador Único de Medicamento (IUM), que é formado pelo número do registro do medicamento junto à Anvisa, contendo 13 (treze) dígitos, além do número serial, a data de validade e o número do lote”.
O número serial é uma espécie de “RG” dos medicamentos, correspondente a cada unidade do medicamento a ser comercializada no território brasileiro. O serial é representado em um código de barras bidimensional e inscrito de forma legível na embalagem de comercialização.
As embalagens secundárias de todos os medicamentos – como, por exemplo, as cartelas de pílulas - e as embalagens hospitalares devem conter os mecanismos de identificação estabelecidos nesta norma da Anvisa.
Para a indústria, o prazo sugerido de adaptação às novas regras é de 180 dias e para o comércio varejista, de 360 dias.
Participação
A Consulta Pública nº 10/2013 irá receber contribuições entre os dias 10 de abril e 9 de maio de 2013. As sugestões podem ser enviadas por meio eletrônico, com preenchimento de formulário específico ou por escrito, para o seguinte endereço: Agência Nacional de Vigilâ ncia Sanitária/GADIP, SIA trecho 5, Área Especial 57, Brasília-DF, CEP 71.205-050.
Já as contribuições internacionais devem ser encaminhadas para o seguinte endereço: Agência Nacional de Vigilância Sanitária/ Núcleo de Assessoramento em Assuntos Internacionais (Naint), SIA trecho 5, Área Especial 57, Brasília-DF, CEP 71.205-050.
As contribuições recebidas são consideradas públicas e estarão disponíveis a qualquer interessado por meio de ferramentas contidas no formulário eletrônico, no menu "resultado", inclusive durante o processo de consulta. A Anvisa deve promover uma audiência pública no mês de maio para subsidiar posteriores discussões técnicas e a deliberação final da diretoria colegiada.
O Sistema Nacional de Controle de Medicamentos (SNCM) institui os mecanismos e procedimentos que vão garantir o rastreamento dos medicamentos. O sistema propõe que o controle comece na produção e acompanhe o medicamento até a prescrição destes produtos.
A Diretoria Colegiada da Anvisa definiu que a tecnologia a ser adotada para o SNCM é o código de barras bidimensional, a Datamatrix. Trata-se do mecanismo de captura, armazenamento e transmissão eletrônica de dados necessários ao rastreamento de medicamentos no Brasil.
A proposta encaminhada para consulta pública por 30 dias determina que a responsabilidade de zelar pela qualidade, pela segurança e pela eficácia dos medicamentos deve ser compartilhada entre todos os agentes que atuam na cadeia de produção, distribuição e consumo desses produtos.
O diretor-presidente da Anvisa, Dirceu Barbano, explica que “as empresas detentoras de registro junto à Anvisa serão responsáveis por gerar e dispor em cada embalagem de medicamento um número chamado de Identificador Único de Medicamento (IUM), que é formado pelo número do registro do medicamento junto à Anvisa, contendo 13 (treze) dígitos, além do número serial, a data de validade e o número do lote”.
O número serial é uma espécie de “RG” dos medicamentos, correspondente a cada unidade do medicamento a ser comercializada no território brasileiro. O serial é representado em um código de barras bidimensional e inscrito de forma legível na embalagem de comercialização.
As embalagens secundárias de todos os medicamentos – como, por exemplo, as cartelas de pílulas - e as embalagens hospitalares devem conter os mecanismos de identificação estabelecidos nesta norma da Anvisa.
Para a indústria, o prazo sugerido de adaptação às novas regras é de 180 dias e para o comércio varejista, de 360 dias.
Participação
A Consulta Pública nº 10/2013 irá receber contribuições entre os dias 10 de abril e 9 de maio de 2013. As sugestões podem ser enviadas por meio eletrônico, com preenchimento de formulário específico ou por escrito, para o seguinte endereço: Agência Nacional de Vigilâ ncia Sanitária/GADIP, SIA trecho 5, Área Especial 57, Brasília-DF, CEP 71.205-050.
Já as contribuições internacionais devem ser encaminhadas para o seguinte endereço: Agência Nacional de Vigilância Sanitária/ Núcleo de Assessoramento em Assuntos Internacionais (Naint), SIA trecho 5, Área Especial 57, Brasília-DF, CEP 71.205-050.
As contribuições recebidas são consideradas públicas e estarão disponíveis a qualquer interessado por meio de ferramentas contidas no formulário eletrônico, no menu "resultado", inclusive durante o processo de consulta. A Anvisa deve promover uma audiência pública no mês de maio para subsidiar posteriores discussões técnicas e a deliberação final da diretoria colegiada.
Imprensa / Anvisa
'via Blog this'
segunda-feira, 1 de abril de 2013
Plano de trabalho traz novos prazos para análise de medicamentos
Plano de trabalho traz novos prazos para análise de medicamentos:
 A Anvisa publicou o novo Plano de Trabalho para o contrato de gestão entre a Agência e o Ministério da Saúde. Entre as novidades do documento estão as metas para redução do tempo de análise do registro de medicamentos, a implantação do processo de registro eletrônico e diminuição do estoque de processo que aguardam há mais de 180 dias para a primeira análise.
A Anvisa publicou o novo Plano de Trabalho para o contrato de gestão entre a Agência e o Ministério da Saúde. Entre as novidades do documento estão as metas para redução do tempo de análise do registro de medicamentos, a implantação do processo de registro eletrônico e diminuição do estoque de processo que aguardam há mais de 180 dias para a primeira análise.
As metas vão trazer impactos diretos na saúde da população. Com os novos compromissos, a chegada de produtos de saúde e medicamentos ao mercado deverá ser mais rápida, ampliando a oferta de tratamentos. A análise de produtos estratégicos para o Sistema ùnico de Saúde (SUS) também será priorizada.
A medida ainda traz impactos positivos para o desenvolvimento da indústria nacional de medicamentos, pois a expectativa é que os fabricantes possam colocar seus produtos no mercado em menos tempo.
O Plano de Trabalho estabelece metas que a Anvisa deve cumprir durante o ano de 2013 e foi assinado na última semana entre o Ministro da Saúde, Alexandre Padilha, e o diretor-presidente da Anvisa, Dirceu Barbano. Ao todo são 21 metas que incluem também melhorias na gestão da Anvisa e aumento do índice de satisfação dos usuários do 0800, entre outros.
Imprensa / Anvisa
 A Anvisa publicou o novo Plano de Trabalho para o contrato de gestão entre a Agência e o Ministério da Saúde. Entre as novidades do documento estão as metas para redução do tempo de análise do registro de medicamentos, a implantação do processo de registro eletrônico e diminuição do estoque de processo que aguardam há mais de 180 dias para a primeira análise.
A Anvisa publicou o novo Plano de Trabalho para o contrato de gestão entre a Agência e o Ministério da Saúde. Entre as novidades do documento estão as metas para redução do tempo de análise do registro de medicamentos, a implantação do processo de registro eletrônico e diminuição do estoque de processo que aguardam há mais de 180 dias para a primeira análise.As metas vão trazer impactos diretos na saúde da população. Com os novos compromissos, a chegada de produtos de saúde e medicamentos ao mercado deverá ser mais rápida, ampliando a oferta de tratamentos. A análise de produtos estratégicos para o Sistema ùnico de Saúde (SUS) também será priorizada.
A medida ainda traz impactos positivos para o desenvolvimento da indústria nacional de medicamentos, pois a expectativa é que os fabricantes possam colocar seus produtos no mercado em menos tempo.
O Plano de Trabalho estabelece metas que a Anvisa deve cumprir durante o ano de 2013 e foi assinado na última semana entre o Ministro da Saúde, Alexandre Padilha, e o diretor-presidente da Anvisa, Dirceu Barbano. Ao todo são 21 metas que incluem também melhorias na gestão da Anvisa e aumento do índice de satisfação dos usuários do 0800, entre outros.
Imprensa / Anvisa
GMP News: New WHO Guideline on the Establishing of Hold Times of Intermediate and Bulk Products
GMP News: New WHO Guideline on the Establishing of Hold Times of Intermediate and Bulk Products:
'via Blog this'
According to the new guideline maximum allowable hold times, that is the period before the next processing step, should be described for starting materials, intermediate and bulk products and supported by data. This data can be collected during development, during process validation, or as part of a deviation with appropriate testing. The data shall demonstrate that there will be no adverse effect to the quality during the hold time. Hold times should be determined prior to marketing of a product and following any significant changes in processes, equipment or packaging materials.
When designing hold-time studies the critical stages of the manufacturing process are to be highlighted that could have an impact because of their duration or the conditions. As an example the guideline contains a list of the stages to be considered for the manufacture of oral solid dosage forms.
Furthermore, the contents of a test protocol are presented as well as the requirements on the containers in which the material under test is to be stored. At this point it is mentioned that the corresponding containers should have head space in proportion to the intermediate or bulk product stored in the analogue container. The data can be gathered by means of one or more batch(es).
Finally, the document contains an exemplary overview of the hold times of the different intermediate steps such as granules and blends. Interim storage of the dosage form in bulk containers should generally not exceed six months.
Comments on the guideline can be submitted until April 2013. The draft of the WHO guideline as well as the template for comments can be found in the members area of the ECA Website.
'via Blog this'
Inspeções internacionais da Anvisa ganham reforço
Inspeções internacionais da Anvisa ganham reforço:
A atuação da Agência Nacional de Vigilância Sanitária (Anvisa) em inspeções internacionais vai ganhar o reforço dos fiscais das vigilâncias sanitárias municipais e estaduais. A partir de agora, as inspeções da Agência em fábricas localizadas no exterior poderá ser composto por servidores das vigilâncias locais com capacitação em Boas Práticas de Fabricação.
A Portaria nº 571/2013 da Anvisa, publicada na última quarta-feira (27/3), traz a relação com os nomes dos servidores do Sistema Nacional de Vigilância Sanitária (SNVS), lotados nas Vigilâncias Sanitárias dos estados e dos municípios, que estão aptos a compor as equipes de inspeção internacional da Agência nas indústrias de medicamentos, insumos farmacêuticos e produtos para a saúde.
O Decreto nº 7930/2013, editado em fevereiro deste ano, abriu a possibilidade de participação de servidores de outros entes da federação na composição de equipes de inspeção internacional realizadas pela Anvisa. Com base no Decreto, a Anvisa publicou a Portaria, que abre uma nova oportunidade de capacitação em campo para os servidores das vigilâncias sanitárias locais e amplia a capacidade de realização de inspeções em fábricas situadas em outros países.
Até o momento, as inspeções internacionais nas indústrias de outros países eram realizadas apenas por servidores da Anvisa. As futuras equipes de inspeção internacional continuarão a ser lideradas por servidores da Agência, mas poderão ter a participação de inspetores que fazem parte do quadro funcional de governos estaduais e de prefeituras, desde que autorizadas pela autoridade sanitária local.
O processo de escolha dos profissionais observou como critérios de seleção a capacidade de comunicação em inglês, o curso de Boas Práticas de Fabricação (BPF) oferecido pela Anvisa e a experiência anterior em fiscalização do processo produtivo em indústrias. Os servidores estaduais e municipais que participarem de equipes de inspeção sanitária internacional ficarão submetidos às normas e regulamentos da Anvisa e da Administração Pública Federal quanto à concessão de passagens e diárias e as respectivas prestações de contas.
Na Anvisa, a Gerência-Geral de Inspeção, Monitoramento da Qualidade, Controle e Fiscalização de Insumos, Medicamentos, Produtos, Propaganda e Publicidade (GGIMP) realizará as atividades necessárias para viabilizar a participação dos servidores designados, bem como a ampliação dos servidores qualificados. À medida que outros inspetores que possuam os requisitos necessários forem identificados, a Portaria poderá ser atualizada para inclusão de novos nomes.
Imprensa/Anvisa
A atuação da Agência Nacional de Vigilância Sanitária (Anvisa) em inspeções internacionais vai ganhar o reforço dos fiscais das vigilâncias sanitárias municipais e estaduais. A partir de agora, as inspeções da Agência em fábricas localizadas no exterior poderá ser composto por servidores das vigilâncias locais com capacitação em Boas Práticas de Fabricação.
A Portaria nº 571/2013 da Anvisa, publicada na última quarta-feira (27/3), traz a relação com os nomes dos servidores do Sistema Nacional de Vigilância Sanitária (SNVS), lotados nas Vigilâncias Sanitárias dos estados e dos municípios, que estão aptos a compor as equipes de inspeção internacional da Agência nas indústrias de medicamentos, insumos farmacêuticos e produtos para a saúde.
O Decreto nº 7930/2013, editado em fevereiro deste ano, abriu a possibilidade de participação de servidores de outros entes da federação na composição de equipes de inspeção internacional realizadas pela Anvisa. Com base no Decreto, a Anvisa publicou a Portaria, que abre uma nova oportunidade de capacitação em campo para os servidores das vigilâncias sanitárias locais e amplia a capacidade de realização de inspeções em fábricas situadas em outros países.
Até o momento, as inspeções internacionais nas indústrias de outros países eram realizadas apenas por servidores da Anvisa. As futuras equipes de inspeção internacional continuarão a ser lideradas por servidores da Agência, mas poderão ter a participação de inspetores que fazem parte do quadro funcional de governos estaduais e de prefeituras, desde que autorizadas pela autoridade sanitária local.
O processo de escolha dos profissionais observou como critérios de seleção a capacidade de comunicação em inglês, o curso de Boas Práticas de Fabricação (BPF) oferecido pela Anvisa e a experiência anterior em fiscalização do processo produtivo em indústrias. Os servidores estaduais e municipais que participarem de equipes de inspeção sanitária internacional ficarão submetidos às normas e regulamentos da Anvisa e da Administração Pública Federal quanto à concessão de passagens e diárias e as respectivas prestações de contas.
Na Anvisa, a Gerência-Geral de Inspeção, Monitoramento da Qualidade, Controle e Fiscalização de Insumos, Medicamentos, Produtos, Propaganda e Publicidade (GGIMP) realizará as atividades necessárias para viabilizar a participação dos servidores designados, bem como a ampliação dos servidores qualificados. À medida que outros inspetores que possuam os requisitos necessários forem identificados, a Portaria poderá ser atualizada para inclusão de novos nomes.
Imprensa/Anvisa
Assinar:
Postagens (Atom)

