Bem Vindo ! Welcome!
Bem vindo ao nosso Blog, é um prazer ter sua visita registrada, esperamos que aprecie nosso conteúdo!T&B Pharma ConsultoriaWelcome to our Blog, it is a big pleasure to have your visit recorded; our expectation is that you enjoy our content!
T&B Pharma Consulting
quinta-feira, 19 de dezembro de 2013
Lei que autoriza PF investigar remédios falsificados é publicada no Diário Oficial | Agência Brasil
Repórter Agência Brasil
Lei que autoriza PF investigar remédios falsificados é publicada no Diário Oficial | Agência Brasil
domingo, 15 de dezembro de 2013
Medicamento usado pelo SUS em transplantados será produzido com matéria-prima nacional | Agência Brasil
Repórter da Agência Brasil
Medicamento usado pelo SUS em transplantados será produzido com matéria-prima nacional | Agência Brasil
A Complex Quality Management System Doesn’t Mean It’s Effective | Quality Digest
According to a report from the London-based Centre for Economics and Business Research, a dollar invested in improving an organization’s approach to quality management results in a six-fold return in increased revenues, and a 16-fold reduction in expenses. The promise of dramatic improvements is just one of the reasons why organizations worldwide are embracing quality management and seeking certification to international quality standards such as ISO 9001.
quinta-feira, 12 de dezembro de 2013
Hypermarcas fecha acordo de US$31 mi com MSD para venda de ativos - geral - geral - Estadão
A empresa receberá da MSD 31 milhões de dólares pelos ativos que já eram de comercialização e propriedade intelectual da MSD, mas que tinha a Hypermarcas como fabricante no Brasil.
As ações da companhia exibiam queda de 0,6 por cento às 10h37, enquanto o Ibovespa tinha oscilação negativa de 0,01 por cento.
Segundo a Hypermarcas, o fechamento e a implementação da operação devem ocorrer no início de 2014, sujeito ao cumprimento de determinadas condições estabelecidas em contrato.
A empresa informou que convocou assembleia extraordinária de acionistas para 27 de dezembro para deliberar sobre a cisão parcial.
A área de fármacos da Hypermarcas encerrou o terceiro trimestre com alta de 15,6 por cento na receita líquida sobre o mesmo período do ano passado.
(Por Roberta Vilas Boas)
terça-feira, 10 de dezembro de 2013
Dispõe sobre a terceirização de etapas de produção, de análises de controle de qualidade e de armazenamento de medicamentos”. - Consulta Pública n° 52, de 03 de dezembro de 2013
análises de controle de qualidade e de armazenamento de medicamentos. veja na integra
Agência Nacional de Vigilância Sanitária - www.anvisa.gov.br
quarta-feira, 4 de dezembro de 2013
DA Warning Letter Statistics 2013 with regard to Process Validation / Qualification / Calibrattion
GMP News
27/11/2013 |
FDA Warning Letter Statistics 2013 with regard to Process Validation / Qualification / Calibration
|
In previous GMP News (27 May 2010, 25 March 2011 and 24 October 2012), we presented FDA "Findings" in the complex topics validation / qualification / calibration in manufacturing with regard to medicinal products. In the following, you will find an analysis of the 37 Warning Letters issued in fiscal year 2013 (from 1st October 2012 to 30 September 2013) on that topic. In 2013, process validation was at the top of the critised deviations. Missing or insufficient process validation was quoted 15 times. The most frequent critics were made to dosage forms (5 times) as well as to the manufacture of creams (3 times). The inexistent validation of a filtration time and of a filter replacement as well as insufficient packaging validation (filling, sealing and labelling) have been criticised too. More and more terms from the "new" FDA Guidance of 2011 appear among the corrective measures; for example "control strategy" and "scientific evidence that your manufacturing process are capable of consistently manufacturing quality products" are required. Deviations regarding missing or insufficient cleaning validation have been observed 7 times; more precisely: the inexistent use of worst case products, handling errors in "swabbing" and missing swab recovery rates were observed and criticised. Media Fills have also been often criticised (4 times) Missing hold times of vials before incubation, inexistent rational numbers for the non-incubating of filled vials, no documentation about the reasons for rejecting vials, and insufficient failure investigation were among the points of criticism. Interestingly, the (non-validated) hold time was necessary as the company hadn't enough resources to evaluate the Media Fills. Also one observation was made to the lack of validation for the Computer software Microsoft Dynamics. Conclusion: The analysis is similar to that of the previous years and the top deficiencies haven't changed that much. The most "Findings" concerned the process validation topic, and again, the majority had to do with solid forms. The number of insufficient Media Fills was also comparable to that of the previous years. Nevertheless, one can notice the increase of qualification deficiencies - whereby also in the past, missing or poor "smoke studies" often appeared. |
sábado, 30 de novembro de 2013
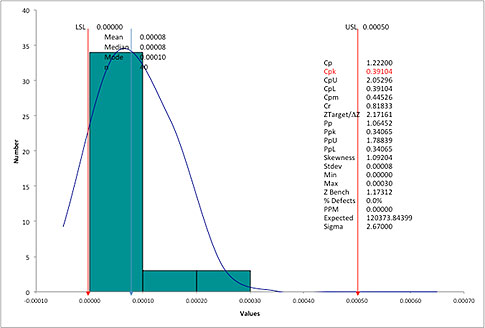
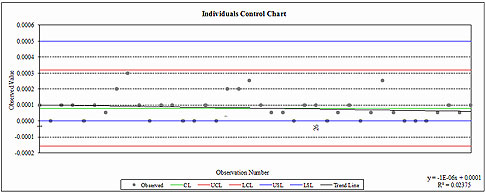
Problems With Process Capability Calculations | Quality Digest
Afew days ago we received an email from a friend at a machine shop. He had just finished a process capability analysis for a critical feature (a runout on a cylindrical part) and was shocked by
| ADVERTISEMENT |
Sources of errors
1. The practitioner has violated one of the assumptions required for proper analysis. (For a list of assumptions, see “Pitfalls to Avoid with Cp, Cpk Process Capability Analysis.”)
2. The practitioner has not taken into consideration the “nature of the characteristic” being measured and has used an incorrect formula, or the software being used does not utilize the correct formula.
The nature of the characteristic
Two challenges with runouts and other geometric dimensioning and tolerancing (GD&T) specifications
1. The process is bounded and the nominal and target = LSL = zero
2. A non-normal distribution
Snif Brasil - Hipertensão atinge 24,3% dos brasileiros, mas complicações são as menores em 10 anos
Por outro lado, o número de pessoas que precisou ser internado na rede pública caiu 25% nos últimos dois anos. Em 2010, o Sistema Único de Saúde (SUS) registrou 154.919 internações decorrentes de complicações da hipertensão; em 2011, o número ficou em 136.633 e foi a 115.748 em 2012. Com isso, o Ministério da Saúde registrou a menor taxa de pessoas internadas para 100 mil habitantes nos últimos 10 anos. A taxa passou de 95,04 em 2002 para 59,67 no ano passado.
“Vários fatores influenciaram essa queda, como por exemplo investimento na atenção básica, mas nenhum foi tão expressivo como o Saúde não Tem Preço. O acesso aos medicamentos para hipertensão retirados pelo Farmácia Popular aumentaram sete vezes nesses dois anos e meio e isso permitiu a redução das internações hospitalares pela hipertensão” avaliou o ministro Alexandre Padilha durante divulgação dos dados.
Em janeiro de 2011, 304.235 brasileiros recorreram à rede para obter medicamentos com desconto para tratar a hipertensão. Com o início da gratuidade, em fevereiro de 2011, o número de atendimentos mensais disparou e foi a 2.162.192 em setembro de 2013. O Saúde Não Tem Preço é um dos destaques do Plano de Ações Estratégicas para o Enfrentamento das Doenças Crônicas Não Transmissíveis, lançado em 2011. A ação oferece gratuitamente seis remédios para controle da doença.
HIPERTENSÃO - A doença é mais comum entre as mulheres (26,9%) que entre os homens (21,3%) e também varia de acordo com a faixa etária e a escolaridade. Entre os brasileiros com mais de 65 anos de idade, 59,2% se declaram hipertensos, contra apenas 3,8% na faixa de 18 a 24 anos e 8,8% de 25 a 34 anos.
Já o tempo médio de ensino é inversamente proporcional à hipertensão: quanto maior a escolaridade, menor a taxa. Entre aqueles com até oito anos de educação formal, 37,8% de hipertensão; na outra ponta, com 12 anos ou mais de ensino, o percentual fica em 14,2%.
FARMÁCIA POPULAR - Com a expansão da cobertura através de convênios com farmácia privadas pelo Aqui tem Farmácia Popular, a rede conta com mais de 23.102 farmácias conveniadas, além de 546 unidades próprias. Unidades estão presentes em 3.742 cidades. Destas, 1.324 são de extrema pobreza. Em 2011, eram apenas 578 municípios cobertos.
Fonte:
Snif Brasil
sexta-feira, 22 de novembro de 2013
Medical Devices Warning Letter Statistics 2013 - Rank 1 for CAPA Deficiencies once more
The number of Warning Letters issued by the Center for Devices and Radiological Health (CDRH) in fiscal year 2013 (199 Warning Letters) has set a new record (181 were issued in 2012). Among the 199 Warning Letters issued in fiscal year 2013, "only" 159 refer to cGMP requirements for medical devices (Quality System Regulations (QSR) in 21 CFR 820).
Regular acquaintances rank the top 5. The results are very similar to those of fiscal year 2012 (see our GMP News from 14 November 2012). The first place goes to CAPA deficiencies - as in the past between 2008 and 2012. "Complaint Files" deficiencies get the second place. In 2012, they shared this place with CAPA deficiencies. Place 3 goes to deviations on "Design Controls" (from 2010 to 2012 they had place 2). Deviations from Chapter 21 CFR 820.80 (Receiving, in-process, and finished device acceptance) get rank 4, whereas they got place 3 in 2012. Besides, "Purchasing Controls" finished fifth (2011/2012: rank 4) .
The classification of the number of criticised deficiencies regarding the "Subparts" of 21 CFR 820 is also interesting. The subpart M "Records" ranks 1st which seems to be due to the fact that many deficiencies relative to Complaint Files are significant for this subpart. Place 2 goes to the subpart "CAPA". Place 3 goes to the subpart "Production and Process Controls" (which also includes process validation). The subpart "Quality Systems Requirements" gets place 4 and "Design Controls" place 5.
The following table compares the evolution in the previous years:
| Year | Number WLs | Top 1 | Top 2 | Top 3 | Top 4 | Top 5 |
| 2002 | 61 | .100 | .75 | .198 | .30 | .70 |
| 2003 | 61 | .100 | .30 | .198 | .20 | .80 |
| 2004 | 104 | .100 | .20 | .22 | .30 | .80 |
| 2005 | 106 | .100 | .198 | .80 | .20 | .22 |
| 2006 | 79 | .100 | .30 | .198 | .80 | .75 |
| 2007 | 78 | .30 | .100 | .198 | .70/.80 | .75 |
| 2008 | 91 | .100 | .198 | .30 | .20 | .80 |
| 2009 | 84 | .100 | .198 | .30 | .20 | .22 |
| 2010 | 182 | .100/.198 | .30 | .75 | .80 | .20 |
| 2011 | 156 | .100 | .30 | .198 | .50 | .75/.80 |
| 2012 | 181 | .100/.198 | .30 | .80 | .50 | .90/.184 |
| 2013 | 199 | .100 | .198 | .30 | .80 | .50 |
21 CFR 820.22: Quality audit
21 CFR 820.30: Design controls
21 CFR 820.50: Purchasing controls
21 CFR 820.70: Production and Process control
21 CFR 820.75: Process validation
21 CFR 820.80: Receiving, in-process, and finished device acceptance
21 CFR 820.90: Nonconforming product
21 CFR 820.100: Corrective and preventive action
21 CFR 820.184: Device History Record
21 CFR 820.198: Complaint files
sexta-feira, 15 de novembro de 2013
Saneantes e Cosméticos Têm Novos Regulamentos de Boas Práticas
Saneantes e Cosméticos Têm Novos Regulamentos de Boas Práticas
As normas, publicadas no DOU nº 209, de 28 de outubro de 2013, foram alinhadas a outras normas da ANVISA, e ao ordenamento jurídico do Mercosul. Com a publicação foram revogadas as Portarias 327/97 e 348/97, anteriores a criação da Agência.
Os novos regulamentos, além de modernizarem as normas existentes, mudaram a lógica de inspeção ao reorganizarem os tópicos a serem abordados e porem fim ao roteiro de inspeção. O foco é a avaliação do risco e o fortalecimento do gerenciamento da qualidade.
O objetivo do novo regulamento de saneantes é normatizar a fabricação, de modo que os fatores humanos, técnicos e administrativos (da fabricação), que podem ter influência na qualidade dos mesmos, sejam eficazmente controlados, visando prevenir, reduzir e eliminar qualquer deficiência na qualidade dos mesmos, que podem afetar negativamente a saúde e segurança do usuário.
Cosméticos
Já a RDC 48/2013, estabelece os procedimentos e as práticas que os fabricantes de cosméticos em geral devem aplicar para assegurar que as instalações, métodos, processos, sistemas e controles usados para a fabricação de produtos de higiene pessoal, cosméticos e perfumes sejam adequados de modo a garantir qualidade desses produtos.
As empresas fabricantes de Saneantes e Cosméticos têm o prazo de um ano para se adequar a norma: elaborar todos os protocolos e outros documentos necessários para a validação de limpeza, metodologia analítica, sistemas informatizados e sistema de água de processo que já se encontrem instalados.
O descumprimento das disposições contidas nestas Resoluções e nos regulamentos por elas aprovados, como expressos nas RDCs, constituem infração sanitária, nos termos da Lei n. 6.437, de 20 de agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e penal cabíveis.
Confira as resoluções:
RDC 47/2013
RDC 48/2013
quarta-feira, 6 de novembro de 2013
Saúde - Ministério da Saúde firma mais um acordo para redução de sal nos alimentos
Brasília - O ministro da Saúde, Alexandre Padilha, firma hoje (5) com a Associação Brasileira de Indústrias de Alimentação (Abia) o quarto pacto para a redução de sódio nos alimentos industrializados. Essa é uma forma de o governo diminuir o alto índice de consumo de sal no país, um dos fatores de risco para doenças crônicas como hipertensão e doenças cardíacas. A previsão é que novos alimentos sejam acrescentados aos três acordos firmados anteriormente.
Em 2011, o Ministério da Saúde assinou o primeiro acordo com a Abia para reduzir o teor de sódio em 16 categorias de alimentos processados, como massas instantâneas, pães e bisnagas, nos próximos quatro anos. Em 2012, o termo de compromisso incluiu a redução de sódio em temperos, caldos, cereais matinais e margarinas vegetais.
Segundo a pasta, a recomendação de consumo máximo diário de sal pela Organização Mundial da Saúde (OMS) é menos de cinco gramas por pessoa. Dados do Instituto Brasileiro de Geografia e Estatística (IBGE) mostram que o consumo do brasileiro está em 12 gramas diários. Pesquisa feita com mais de 54 mil brasileiros em 2011 mostrou que a hipertensão arterial atingia 22,7% da população adulta.
O ministro também vai apresentar hoje dados inéditos da pesquisa Vigitel 2012 - Vigilância de Fatores de Risco e Proteção para Doenças Crônicas por Inquérito Telefônico - sobre a hipertensão arterial no país.
Edição: Graça Adjuto
Todo o conteúdo deste site está publicado sob a Licença Creative Commons Atribuição 3.0 Brasil. Para reproduzir as matérias, é necessário apenas dar crédito à Agência Brasil
EMA and FDA Release QbD Guidance - Pharmaceutical Technology
| Nov 4, 2013 |
In March 2011, FDA and EMA launched a three-year pilot program for the parallel assessment of certain quality or chemistry manufacturing and control (CMC) sections of applications that are relevant to QbD. The objective of the program is to share knowledge and harmonize implementation of the QbD concept. Experts from the Japanese Pharmaceuticals and Medical Devices Agency participate as observers in the program.
According to EMA, the pilot program is open to selected procedures, including applications for initial marketing authorizations, type-II variations, and scientific advice. Participation in the pilot program is voluntary. Interested applicants and sponsors should notify both agencies three months prior to submission of an application.
Source: European Medicines Agency
source link:
EMA and FDA Release QbD Guidance - Pharmaceutical Technology
Hipertensão atinge 24,3% da população adulta | Blog da Saúde
| Capitais/DF | Total % | Masculino % | Feminino % |
|---|---|---|---|
| Aracajú | 26,6 | 24,9 | 28,1 |
| Belém | 17,9 | 16,7 | 19,0 |
| Belo Horizonte | 25,9 | 23,9 | 27,7 |
| Boa Vista | 16,6 | 17,0 | 16,2 |
| Campo Grande | 25,9 | 23,3 | 28,3 |
| Cuiabá | 25,2 | 20,9 | 29,2 |
| Curitiba | 24,2 | 21,2 | 26,8 |
| Florianópolis | 21,7 | 19,1 | 24,1 |
| Fortaleza | 20,8 | 18,0 | 23,2 |
| Goiânia | 22,9 | 20,3 | 25,2 |
| João Pessoa | 25,7 | 21,4 | 29,2 |
| Macapá | 19,3 | 14,6 | 23,7 |
| Maceió | 26,7 | 23,3 | 29,4 |
| Manaus | 19,0 | 16,2 | 21,6 |
| Natal | 24,8 | 20,3 | 28,5 |
| Palmas | 17,2 | 17,1 | 17,4 |
| Porto Alegre | 26,2 | 23,3 | 28,6 |
| Porto Velho | 18,9 | 14,8 | 23,2 |
| Recife | 26,9 | 22,5 | 30,4 |
| Rio Branco | 22,4 | 18,2 | 26,1 |
| Rio de Janeiro | 29,7 | 25,4 | 33,2 |
| Salvador | 25,7 | 23,7 | 27,4 |
| São Luís | 18,2 | 14,9 | 20,9 |
| São Paulo | 23,5 | 20,0 | 26,6 |
| Teresina | 20,9 | 19,4 | 22,0 |
| Vitória | 24,7 | 22,5 | 26,5 |
| Distrito Federal | 23,9 | 24,0 | 23,8 |
Fonte: Fabiane Schmidt / Agência Saúde
link:
Hipertensão atinge 24,3% da população adulta | Blog da Saúde
segunda-feira, 4 de novembro de 2013
quarta-feira, 30 de outubro de 2013
Vacinação | Brasil produz 90% das vacinas oferecidas no SUS | Blog da Saúde
Vacinação | Brasil produz 90% das vacinas oferecidas no SUS
Vacinação | Brasil produz 90% das vacinas oferecidas no SUS | Blog da Saúde
quinta-feira, 24 de outubro de 2013
GMP News: How to share Audits
One of the most important tools in supplier qualification is the on-site audit. Although the QP is not obliged to perform the audit him- or herself, the responsibility stays with the QP. A possibility in saving resources is sharing an audit.
Snif Brasil - Indústrias farmacêutica e farmoquímica brasileira buscam internacionalização na CPHI Worldwide 2013
As companhias presentes são: Biolab Sanus, Biocinese, CAEP - Centro Avançado de Estudos, Cristália, EMS, Eurofarma, Extrasul, Formil, Globe, Hypermarcas, Instituto de Ciências Farmacêuticas - ICF, LAIF/PUC RS - Laboratório Analítico de Insumos Farmacêuticos, Merck Sharp & Dohme, Nortec Quimica e União Química.
A ação faz parte do Brazilian Pharma Solutions - projeto de internacionalização dos setores Farmacêutico e Farmoquímico, coordenado pela Abiquifi - Associação Brasileira da Indústria Farmoquímica e de Insumos Farmacêuticos, em parceria com a Agência Brasileira de Promoção de Exportações (Apex-Brasil) e com apoio das entidades Abifina, Alanac, Sindusfarma e Pró Genéricos.
O projeto é responsável por toda a infraestrutura do Pavilhão Brasileiro, que é o ponto de encontro de empresários e profissionais do País que visitam a CpHi todos os anos. Os principais representantes governamentais do Complexo Industrial da Saúde estão presentes no evento, como a Agência Nacional de Vigilância Sanitária (Anvisa) e o Banco Nacional de Desenvolvimento Econômico e Social (BNDES), entre outros.
Entidades brasileiras representantes do setor também marcam presença no pavilhão brasileiro, dentre elas, Telma Salles, presidente executiva da Pró Genéricos e Lauro Moretto, vice-presidente executivo do Sindusfarma. O pavilhão brasileiro conta com um auditório onde são realizadas palestras direcionadas aos empresários brasileiros.
O Brazilian Pharma Solutions também apoia a participação do Brasil no "Global Opportunities Lunchtime Series - Brazil Opportunities". O fórum acontecerá durante a feira e apresentará informações sobre o potencial do mercado, investimentos e ambiente regulatório no Brasil, ressaltando seu esforço pela internacionalização e atração de parcerias estratégicas.
Participam deste encontro 100 convidados internacionais, entre CEOs e altos executivos da indústria farmacêutica mundial. "Este evento tem como objetivo maximizar a presença dos empresários e contribuir para o aumento do networking e das oportunidades de negócios", informa José Correia, Presidente da Abiquifi.
A CPHI Worldwide é o principal encontro mundial da indústria farmacêutica. Em 2013, celebra sua 24ª edição, contando com mais de 30.000 visitantes provenientes de cerca de 140 países, além de 2.200 expositores.
Snif Brasil
Snif Brasil - Brasileiros descartam 10,3 toneladas de remédios por ano
Brasileiros descartam 10,3 toneladas de remédios por ano
O levantamento foi apresentado durante o “Seminário de Boas Práticas Regulatórias”, que tem como objetivo estimular o debate sobre regulação de um sistema de descarte no setor. A diretora da ABDI, Maria Luisa Campos Machado Leal, diz que o estudo e a discussão de boas práticas regulatórias contribuem para o desenvolvimento industrial, uma vez que auxiliam na formulação de uma regulação sobre resíduos sólidos.
Essas boas práticas, diz Maria Luisa, estimulam as empresas a investirem em inovação, pois a destinação correta e a reciclagem fazem com que haja “um novo conceito na concepção de novos produtos.” Ela acredita que este processo de regulamentação precisa ser feito de forma democrática, ouvindo consumidores e a indústria.
O levantamento “Logística Reversa de Medicamentos” traz um panorama do setor em relação à geração de resíduos, além de experiências internacionais da política de coleta de medicamentos, avaliação do sistema de tratamento de resíduos e possibilidades de destinação correta no Brasil, e aponta os benefícios de um descarte adequado. O estudo mostra ainda estimativas de crescimento da geração de resíduos até 2017, tomando como base dados referentes ao ano de 2010.
Professor da Unicamp e responsável pela elaboração do estudo, Célio Hiratuca observa que hoje grande parte dos medicamentos vai para o lixo comum ou rede de esgoto (quando descartado no vaso sanitário) após o uso. Ele explica que, na medida em que o uso de medicamentos aumenta, também cresce esse descarte inadequado, o que leva possivelmente a uma maior contaminação do lençol freático, de rios e outras consequências negativas.
O estudo propõe uma modelagem de logística reversa para medicamentos. O Ministério do Meio Ambiente, por meio da Secretaria de Recursos Hídricos e Ambiente Urbano lançou um edital de chamamento, no dia 10 de outubro, para a apresentação de proposta de Acordo Setorial visando à implementação de um sistema de descarte de resíduos de medicamentos, que deverá contar com prazo e meta de recolhimento. Os fabricantes, importadores, distribuidores e comerciantes de medicamentos deverão apresentar uma proposta de Acordo Setorial ao Ministério do Meio Ambiente em até 120 dias, contados a partir da data da publicação. Segundo o professor da Unicamp, o ideal seria retornar o medicamento para a farmácia que conduziria o produto para o descarte adequado.
Snif Brasil
quarta-feira, 23 de outubro de 2013
Empresa russa Biocad no Paraná - Medicamento genérico oncológico
Unidade será a primeira da Biocad na América do Sul
A companhia farmacêutica russa Biocad está planejando investir US$ 40 milhões na abertura de uma fábrica no Paraná, sua primeira instalação em um país da América do Sul. No local, a empresa pretende produzir versões genéricas de uma droga utilizada no tratamento contra o câncer e dois outros remédios. Postado no portal Dikajob.
Segundo o diretor executivo da Biocad no Brasil, David Zylbergeld, parte do financiamento do projeto de produção dos biossimilares ficará sob responsabilidade do Banco Nacional de Desenvolvimento Econômico e Social (BNDES) já que se trata de uma área estratégica para o governo. Ele explica que só no ano passado o Brasil gastou mais de US$ 200 milhões com esses medicamentos que serão fabricados no Paraná, o trastuzumabe, o rituximabe e o peginterferão.
Ao todo, o Ministério da Saúde brasileiro investiu quase US$ 3 bilhões em remédios em 2012 e, de acordo com os planos do governo, esse valor deve chegar aos US$ 14 bilhões em 2016, um ano depois do início das operações da Biocad no Brasil. De acordo com Zylbergeld, ainda não se sabe quanto as autoridades pretendem gastar com a aquisição dessas drogas nos próximos anos, mas o fato de haver versões genéricas delas e produzidas no próprio país implicará numa grande economia para os cofres públicos.
quarta-feira, 16 de outubro de 2013
GMP News: USP Draft of a newly proposed Chapter
- metered-dose and dry powder inhalants
- nasal sprays
- otics
- vaginal suppositories
- topicals
- rectal suppositories
- oral liquids (aqueous)
- liquid-filled capsules
- oral tablets and powder-filled capsules
Source/Fonte:
GMP News: USP Draft of a newly proposed Chapter – <1115> Bioburden Control of Nonsterile Drug Substances and Products
terça-feira, 15 de outubro de 2013
quarta-feira, 9 de outubro de 2013
Anvisa proíbe venda de insumo de xarope infantil - DIKAJOB

Além disso, a agência alerta que a partir desta sexta-feira, 04, está proibida a distribuição e a comercialização, em todo o País de todos os lotes do produto "Tesão de Vaca", fabricado pela empresa K-Lab (Nilton Roancini Junior ME). A determinação é motivada pelo fato de a bebida não apresentar na rotulagem as advertências obrigatórias previstas na legislação sanitária, tais como a indicação das quantidades de cafeína e de taurina presentes na fórmula. Outra infração cometida pelo fabricante é apresentar, como denominação de venda, uma expressão que indica o produto como estimulante.
Anvisa proíbe venda de insumo de xarope infantil - DIKAJOB
domingo, 6 de outubro de 2013
Inova Saúde | Projetos de pesquisa e inovação superam expectativas | Blog da Saúde
Inova Saúde | Projetos de pesquisa e inovação superam expectativas
 As propostas apresentadas por empresas para o financiamento de projetos de pesquisa e inovação na área de medicamentos já ultrapassam os valores oferecidos pelo Programa Inova Saúde. A iniciativa, lançada no primeiro semestre de 2013 para apoiar o setor, foi um dos temas debatidos nesta quinta-feira (3) no Fórum Inovação 2013, em São Paulo. O evento, realizado pela Agência Brasileira da Inovação (Finep), contou com a participação do Secretário de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, Carlos Gadelha.
As propostas apresentadas por empresas para o financiamento de projetos de pesquisa e inovação na área de medicamentos já ultrapassam os valores oferecidos pelo Programa Inova Saúde. A iniciativa, lançada no primeiro semestre de 2013 para apoiar o setor, foi um dos temas debatidos nesta quinta-feira (3) no Fórum Inovação 2013, em São Paulo. O evento, realizado pela Agência Brasileira da Inovação (Finep), contou com a participação do Secretário de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, Carlos Gadelha.Inova Saúde | Projetos de pesquisa e inovação superam expectativas | Blog da Saúde